
岩石を作っている鉱物が「造岩鉱物」で,造岩鉱物はほとんどケイ素と酸素で成り立っている。このような鉱物を「ケイ酸塩鉱物」という。この鉱物の結晶は図のようなケイ素1個と酸素4個が正四面体の形で繋がったものを基本単位としていて,この正四面体SiO4が様々な形に集まってできている。ケイ素は4個の外殻電子を有し,酸素は6個の電子を有している。ケイ素は4つの酸素から1個ずつ電子をもらって8個になり安定化するが,酸素はケイ素から1個電子をもらうが,まだ1個電子が不足した状態となっている。このためほかの原子や分子とくっつき,様々な結晶を作り出す。「三つの石で地球がわかる」から代表的なケイ酸塩鉱物を紹介する。

(1)「単独型」の橄欖石(図4−7)
SiO4正四面体の酸素原子がマグネシウム(イオン半径0.7Å)や鉄原子(0.6Å)から電子を調達してくる形(イオン結合)で安定化している。SiO4正四面体が単独でバラバラに存在する。マグネシウムと鉄の比率は,どちらの元素も電子を2個放出したプラスイオンでイオン半径も同じくらいで固溶体となり,どの割合で混じっても橄欖石という。マントル中の橄欖石はマグネシウムと鉄の比率が9:1である。

(2)「単鎖型」の輝石(図4−9)
輝石はSiO4正四面体にマグネシウム,鉄,カルシウム,ナトリウム,アルミニウム,クロム,リチウムなどの原子が結合する。SiO4正四面体同士が,1個の酸素原子を共有して結合したものが,一本の鎖のように長くつながる。SiO4正四面体が隣同士で共有する酸素原子を1/2個と勘定すると1つの正四面体の持つ酸素原子は3個になる。橄欖石の酸素とケイ素の割合は4:1だったのが,3:1に変わり,ケイ素の含有率が上がる。

(3)「複鎖型」の角閃石(かくせんせき)(図4−10)
角閃石はマグネシウム,鉄,マンガン,カルシウム,カリウム,ナトリウム,フッ素,リチウムなどの元素と結合してできる。輝石は1本の鎖であったが,角閃石では2本の鎖でできていてそれがくっついた構造になっている。共有する酸素原子は場所によって2個ないしは3個となっている。ケイ素の含有率はさらに上がる。この構造では真ん中に大きな空間が形成されるためOH,水酸基が入ることができる。酸素のイオン半径は1.3Å,水素は1.5Åである。こうした鉱物は水を生み出すことができるので「含水鉱物」と言われる。
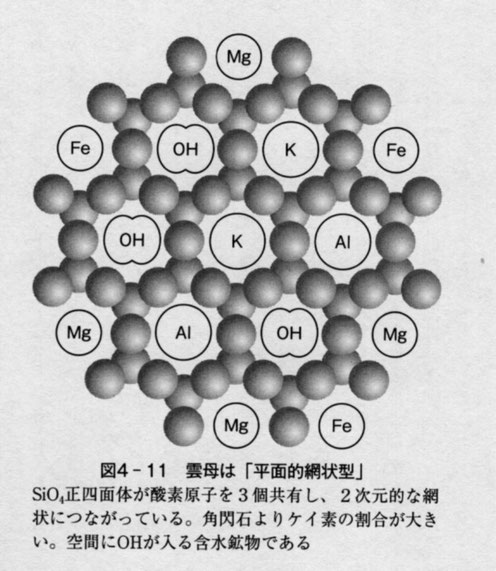
(4)「平面的網状型」の雲母
雲母は隣り合うSiO4正四面体が酸素原子3個共有していて,平面を構成する二次元的な繋がりになっている。このような結晶構造を「平面的網状型」という。分子間の隙間は大きな空間でOH受け入れることができ,含水鉱物となる。共有される酸素原子の数がさらに増え結晶全体に占めるケイ素の割合はさらに大きくなる。
(5)「立体的網状型」の石英と長石
石英も長石も4個の酸素原子をすべて隣接するSiO4正四面体と共有している。したがって酸素原子が事実上2個となり,SiO2の結晶とみなされる。このような構造を「立体的網状型」という。鉱物全体の酸素とケイ素の比率は2:1となり,橄欖石と比べると2倍になっている。緊密な立体構造となったことで分子間の隙間は小さくなり,OHは入り込めなくなる。石英は主に酸素とケイ素のみでできているが,長石はナトリウム,カルシウム,カリウムを含む鉱物である。
(6)その他の造岩鉱物(ケイ素を含有しない鉱物)
磁鉄鉱,チタン鉄鉱
スピネル(尖晶石):アルミニウムの酸化物,SiO4正四面体のケイ素がアルミニウムに置き換わった鉱物

コメントをお書きください
あ (木曜日, 16 7月 2020 12:34)
くそわかりづらい
吉田英雄 (木曜日, 16 7月 2020 12:47)
分かりにくくて申し訳ありません。
興味があればぜひ原本を読んでみてください。