元素単体の個体としての強度は何で決まるか?
大学で金属の講義を受けるとまず格子欠陥の説明があり,転位(dislocation)を教わる。この転位をベースに強度理論が作られている。したがって,転位ありきの理論で転位が存在できないような共有結合性物質や転位がそもそも存在できないような高純度の金属の強度について説明できないことになる。
工業的には金属材料だけでなく,共有結合材料,静電結合材料など各種の材料があり,その強度理論が材料によって異なり統一性がないのは科学としては問題であろう。科学は普遍性を求めるものであり,それを追求するのが学問である。
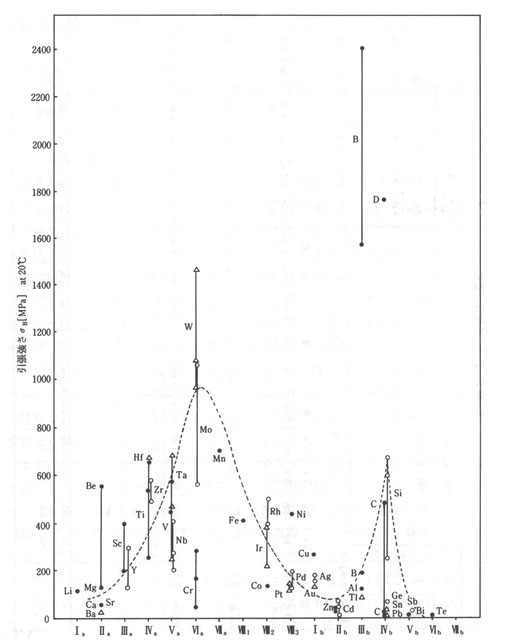
さて,材料の強度を周期律に従って並べたのが図1である。強度はVIa族とIVb族でピークがあることがわかる。強度がなぜ周期律上でこのような変化をするのかを結合エネルギー,凝集エネルギーの観点から明らかにしよう。
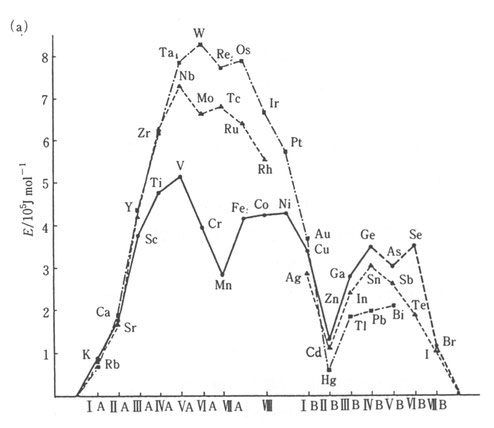
材料の凝集エネルギーを周期律に従って並べたのが図2である。凝集エネルギーもVIa族とIVb族でピークがあることがわかる。VIa族では後の周期ほどIVb族で前の周期ほど凝集エネルギーは大きくなることがわかる。凝集エネルギーは材料強度と相関性があることがわかる。
凝集エネルギーΔEは
ΔE=E0(自由電子のエネルギー)ー E(結晶エネルギー)
=各結合の結合エネルギーの総和
=(結合エネルギー)x(配位数)
=昇華熱
凝集エネルギーは各元素の結合性を反映したものである。
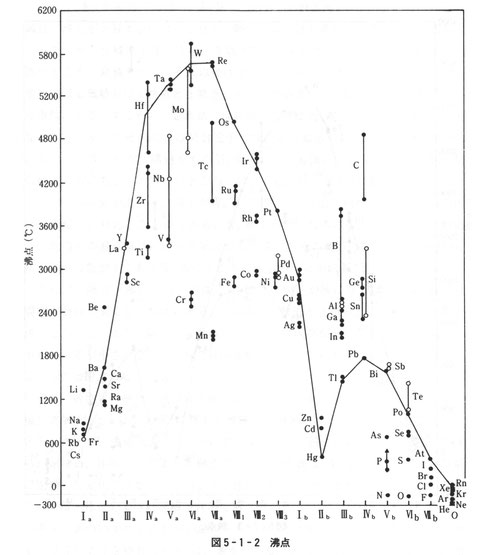
各元素の結合性を反映した物性に融点や沸点がある。融点と周期律の関係を図3に,沸点と周期律の関係を図4に示す。融点,沸点ともにVIa族とIVb族でピークがある。遷移元素では後の周期ほど典型元素では前の周期ほど融点,沸点は高くなる。
Ia, IIa族とともに融点・沸点が上がるのは原子価電子が増えてVIa族で最高を示し,それ以後は族とともに低下する。価電子数が結合軌道に等しいところで最も強い結合が形成される。
第1周期はs軌道,第2,3周期はsp混成軌道,第4,5,6周期は長周期はsd混成軌道,短周期はsp混成軌道,第7,8周期はsf混成軌道とd軌道の一部が結合に関与する。各軌道には2個の電子の座席がある。p軌道には3種類,d軌道には5種類,f軌道には7種類,それぞれの軌道には2個の電子が入る。
従って第1周期にはs軌道で2,第2,3周期にはsp混成軌道で8個,第4,5,6周期にはsd混成軌道で12個,第7,8周期にはsf混成軌道16個にd軌道も関与して18個の座席数がある。VIa族ではsd5混成軌道を形成し,12個の座席に半分の価電子が埋まり,隣の原子の電子と座席を共有する電子が多いほど強い共有結合性が生じる。IVb族ではsp3混成軌道の8個の座席の半分が埋まり,残りの座席を隣の原子と共有し,共有結合が形成される。s軌道とp軌道は周期が前になるほど, s軌道とd軌道は周期が後になるほど混成軌道が形成されやすくなるために,遷移元素では後の周期ほど典型元素では前の周期ほど融点,沸点は高くなる。
凝集エネルギーは結合エネルギーと密接な関係にあり,元素の電子状態に関係していることがわかる。従って,材料強度は電子状態から考えることが重要である。強度とは結合の強さ・均一性に規定され,直接的には系のエネルギーの原子間距離依存性として理解される。
原子間距離をわずかに変化させた場合に系のエネルギーが増加する場合には強度が高くなり,あまり変化しない場合は強度は小さい。系のエネルギーが原子間距離に最も影響するのは,局在性・異方性の強い共有結合であり,ついで静電結合である。金属結合は非局在的・等方的結合から比較的小さい力で変形する。
金属の強度を上げるには合金にして共有結合性を増すことが必要である。Fe合金,Co合金,Ni合金に置いて強度を上げる目的で添加される元素は,共有結合性の強いIVb族を中心としたB, C, N, Al, Siなどと,VIa族を中心とした Cr, Mo, W, V, Nb, Ta, Ti, Zr, Hfなどである。Al合金でも共有結合性の強い Mg, Si, Liなどが添加されるが,Siは固溶度が小さいのでその影響が小さい。
(山本悟,田辺晃生「新しい材料科学ー量子力学に基づく統一的理解ー」昭和堂,1990. より)


コメントをお書きください